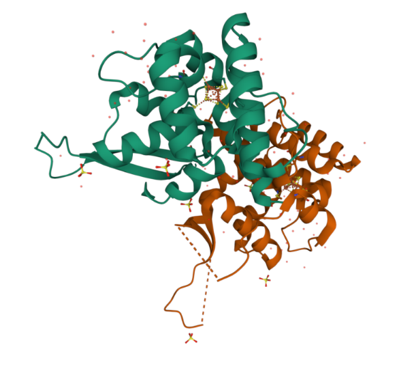
Struktura przestrzenna przykładowego białka zawierającego centrum żelazo-siarkowe
Dr hab. Rafał Dutkiewicz, prof. UG z Międzyuczelnianego Wydziału Biotechnologii UG i GUMed otrzymał dofinansowanie w wysokości 688 080 złotych w ramach konkursu PRELUDIUM BIS 5 ogłoszonego przez Narodowe Centrum Nauki.
Dofinansowanie zostało przyznane w kategorii Nauki o Życiu za projekt Rola in vivo systemu białek opiekuńczych HscA/HscB w biogenezie centrów żelazo-siarkowych (Fe-S) u Escherichia coli. O planach badawczych oraz ich przełomowości rozmawiamy z prof. Rafałem Dutkiewiczem.
Julia Bereszczyńska: - Jaki jest cel Pana badań?
Dr hab. Rafał Dutkiewicz, prof. UG: - Obecnie nasze badania koncentrują się na poznaniu molekularnych mechanizmów udziału białek opiekuńczych Hsp70 oraz współpracujących z nimi białek pomocniczych J (J-proteins) w procesie biogenezy centrów żelazo-siarkowych (Fe-S) będących grupami prostetycznymi niezbędnymi dla funkcjonowania licznych białek. Biologiczna użyteczność centrów wynika z ich wyjątkowej zdolności do wiązania i uwalniania elektronów. Białka zawierające centra Fe-S funkcjonują w kluczowych procesach komórkowych: fosforylacji oksydacyjnej, asymilacji azotu, syntezie metabolitów, biogenezie rybosomów, replikacji i naprawie DNA. Pomimo ich prostej struktury biogeneza centrów Fe-S jest złożonym i słabo poznanym procesem, w który zaangażowane są wyspecjalizowane białka tworzące wielobiałkowe kompleksy. Oddziaływania białko-białko pomiędzy składnikami tych kompleksów mają kluczowe znaczenie dla ich aktywności. Dotychczas nasze badania koncentrowały się na identyfikacji i charakterystyce biochemicznej tych oddziaływań przy użyciu oczyszczonych białek biorących udział w biogenezie centrów Fe-S u Escherichia coli.
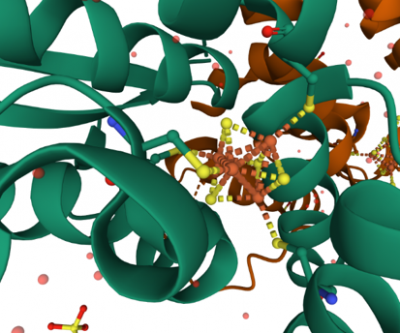
Zbliżenie na centrum 4Fe-4S. Centrum 4Fe-4S jest koordynowane przez cztery reszty cysteinowe. Kolorem żółtym oznaczono atomy siarki, a kolorem czerwonym atomy żelaza.
- Na czym polega przełomowość Pana badań?
- Pomimo szczegółowej analizy biochemicznej niewiele wiadomo na temat znaczenia tych oddziaływań dla biogenezy białek zawierających centra Fe-S in vivo. W tym projekcie opracujemy model badawczy, który pozwoli na badanie fizjologicznych konsekwencji zaburzeń poszczególnych oddziaływań pomiędzy białkami biorącymi udział w biogenezie centrów Fe-S in vivo. W tym celu nawiązaliśmy współpracę z dr Beatrice Py (Aix-Marseille Université-CNRS), która jest ekspertem w dziedzinie badań genetycznych procesu biogenezy centrów Fe-S bakterii. Przygotujemy szczep E. coli, pozwalający na ekspresję genów kodujących warianty białek defektywnych w poszczególnych oddziaływaniach białko-białko, co pozwoli badać rolę tych interakcji podczas syntezy białek zawierających centra Fe-S. Wyznacznikiem tego projektu jest innowacyjne połączenie szczegółowych badań biochemicznych z analizami in vivo. Dzięki temu poznamy molekularne mechanizmy leżące u podstaw tego ważnego procesu metabolicznego.
- Jaki wpływ na funkcjonowanie organizmu mogą mieć zaburzenia poszczególnych oddziaływań pomiędzy białkami biorącymi udział w biogenezie centrów Fe-S?
- Białka zaangażowane w biogenezę Fe-S są konserwowane ewolucyjnie i ortologi białek przez nas badanych zostały zidentyfikowane także u ssaków, w tym również u człowieka. Ten silny konserwatyzm można tłumaczyć tym, że centra Fe-S produkowane w mitochondriach są niezbędne dla przeżycia każdej komórki eukariotycznej. Dzięki temu konserwatyzmowi wyniki badań doświadczalnych uzyskane z zastosowaniem bakterii czy drożdzy, jako dogodnych organizmów modelowych, są łatwo przekładalne na system ludzki. Ma to ogromne znaczenie, ponieważ u kręgowców, a zwłaszcza u ssaków, delecja poszczególnych genów kodujących białka uczestniczące w mitochondrialnej biogenezie Fe-S jest letalna na wczesnych etapach rozwoju embrionalnego. U człowieka mutacje uszkadzające funkcje tych genów prowadzą do licznych schorzeń, często kończących się śmiercią już w bardzo młodym wieku. Do schorzeń powiązanych z zaburzeniami biogenezy Fe-S zaliczamy między innymi ataksję Friedricha, miopatię z kwasicą mleczanową oraz różne rodzaje niedokrwistości syroblastycznej.
- Czy jest szansa, że dzięki tym badaniom będzie możliwa w przyszłości terapia chorób, które są wywołane przez zaburzenia biogenezy Fe-S?
- Ponieważ zaburzenia biogenezy Fe-S u człowieka, na przykład na skutek mutacji białek w nim uczestniczących, są przyczyną wielu chorób często kończących się śmiercią, otrzymane przez nas wyniki pomogą w zrozumieniu molekularnego podłoża tych schorzeń, a być może w dłuższej perspektywie przyczynią się do opracowania skutecznej terapii.
